


Accueil > Nos formations > Dispositifs médicaux > Expert en Affaires règlementaires pour les dispositifs médicaux

Les dates pour cette formation ne sont pas encore fixées. N'hésitez pas à réserver votre place sans engagement.
CHF 7 220.–
CHF 6 752.– (membres SAQ)
Préparation ARIAQ à l’examen : CHF 200.–
Examen et certificat SAQ : CHF 750.–
Prérequis aux examens : Elaboration d’un projet (mémoire qui sera soutenu) en DM management de la Qualité
Examen écrit : 4 heures
Examen oral : environ 30 min.
La préparation à l’examen est facultative.
L’examen oral est sous la supervision d’un expert externe indépendant désigné par la SAQ selon la norme ISO 17024.
Nos tarifs comprennent les pauses et les documents stagiaires.

Ingénieur packaging senior, Frédérique a une expérience de 13 ans dans le développement et la qualification des systèmes d’emballage, dont plus de 11 ans dans l'industrie médicale. Elle a travaillé sur de multiples projets d'amélioration, de développement et qualification des designs et procédés liés aux emballages & étiquetage de dispositifs médicaux implantable et stériles, Elle a également obtenue la certification “Six Sigma Black Belt”.

Biologiste, 10 ans à la direction d'un laboratoire d'essais pour l'analyse microbiologique, chimique, biologique et physique d'appareils médicaux et de produits pharmaceutiques. Activités principales liées à l’évaluation biologique/toxicologique de dispositifs médicaux, validations de nettoyage, contrôle du retraitement, méthodes de validation d’essais (EP, USP, ISO, ICH, ASTM…), problématiques de fabrication. Forte expertise pratique acquise en tant que prestataire de services pour les entreprises multinationales ainsi que pour des start-ups.

19 ans d'activité dans l’industrie (bio-)pharmaceutique en tant que responsable de groupes pour des entreprises internationales dans les départements QA, QC, production et développement des procédés. Participation active à des inspections de régulateurs nationaux tels que Swissmedic, FDA, ANVISA, WHO, … Consultant indépendant depuis 2007, fondateur et directeur de la société « PMS Process Management System Sàrl ».

M. Yacine Gérard est actuellement responsable du département de validation et d’Assurance Qualité chez Medistri SA, une entreprise suisse spécialisée dans les procédés de stérilisation. Depuis la sortie de la norme ISO 11135-1 en 2007, il a été en charge du management de plus d’une centaine de projets de validation, couvrant des familles de produits aussi diverses que des implants. Yacine est au bénéfice d’un CAS en Management de la Technologie, avec une spécialisation en dispositifs médicaux.

Directeur en Qualité et Affaires Réglementaires auprès de grandes multinationales. Khalid a débuté dans l’ingénierie biomédicale et il a acquis de l’expérience en tant que chef de projets R&D sur différents types dispositifs et classes. Son parcours professionnel lui permet de mettre en œuvre de manière constructive et pragmatique un SMQ pour le développement de produits.

Ingénieur en automation, Julien a une expérience de plus de 7 ans dans l’automation (systèmes d’assemblage automatique) dont plus de 5 ans dans l’industrie médicale avec une expertise dans la validation CSV (Computer Software Validation). Cela lui a permis de mettre en place et gérer plusieurs systèmes automatisés en ce qui concerne la validation CSV pour la production de dispositifs médicaux de classe 1 & 3.

Mickaël a plus de 15 ans d’expérience professionnelle au sein de fabricants internationaux de dispositifs médicaux stériles et de produits issus de la Biotechnologie pour lesquels il a occupé diverses fonctions d’expert en Assurance Qualité et Affaires Réglementaires de produits de class III à class I (D à A). Microbiologiste de formation et Lead Auditor ISO 13485, il a durant sa carrière, géré des projets complexes et pluridisciplinaires, avec récemment la mise en conformité de dispositifs médicaux selon nouveaux Règlements MDR 2017/ 745-746, FDA 21 CFR et PMD Act. Ses expertises démontrées quant à la qualification des équipements et de l’environnement de production, à la validation des procédés de fabrication, de stérilisation et expertise relative à la surveillance des dispositifs médicaux commercialisés en font un partenaire de confiance pour les clients ARIAQ.
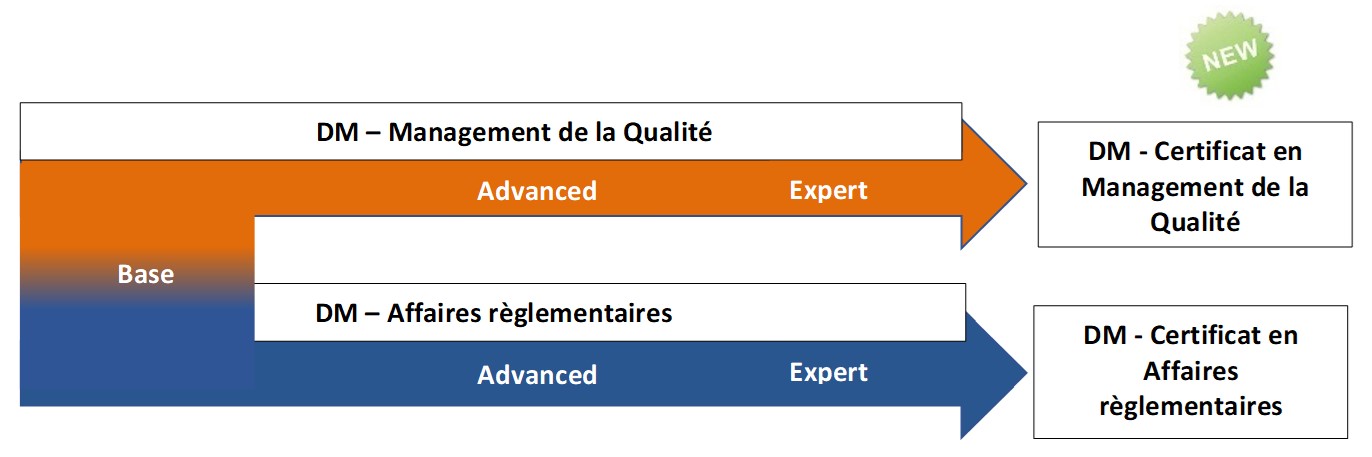
Expert en
Management de la qualité pour les dispositifs médicaux
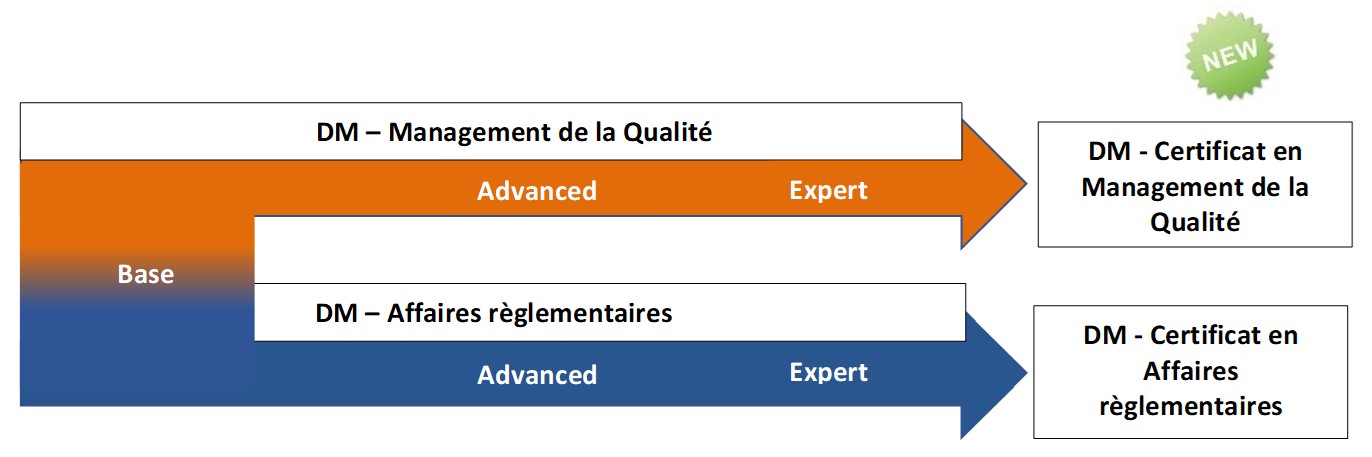
Advanced en Affaires règlementaires pour les dispositifs médicaux
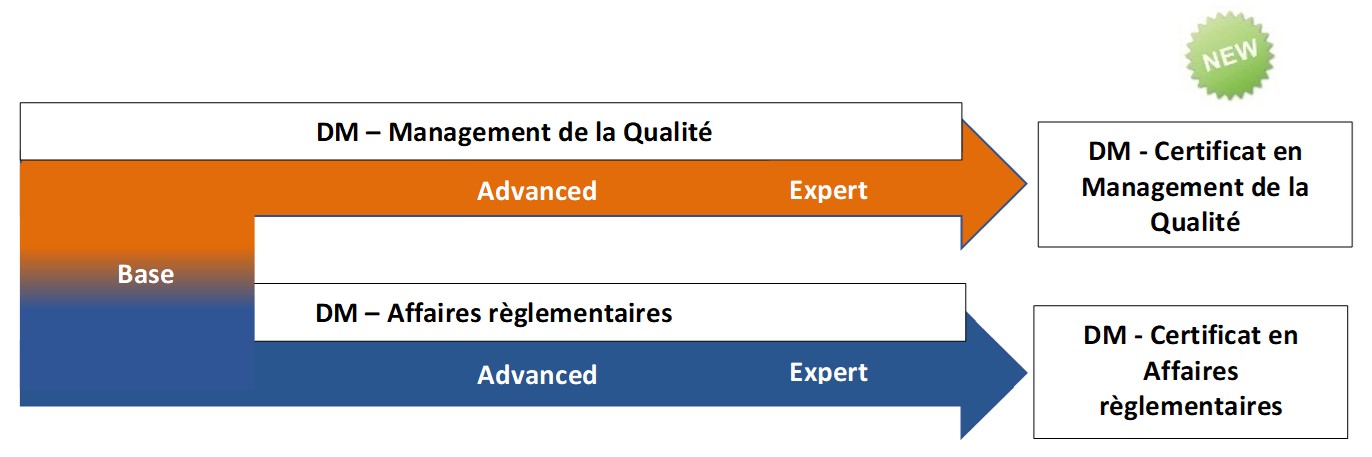
Advanced en Management de la qualité pour les dispositifs médicaux
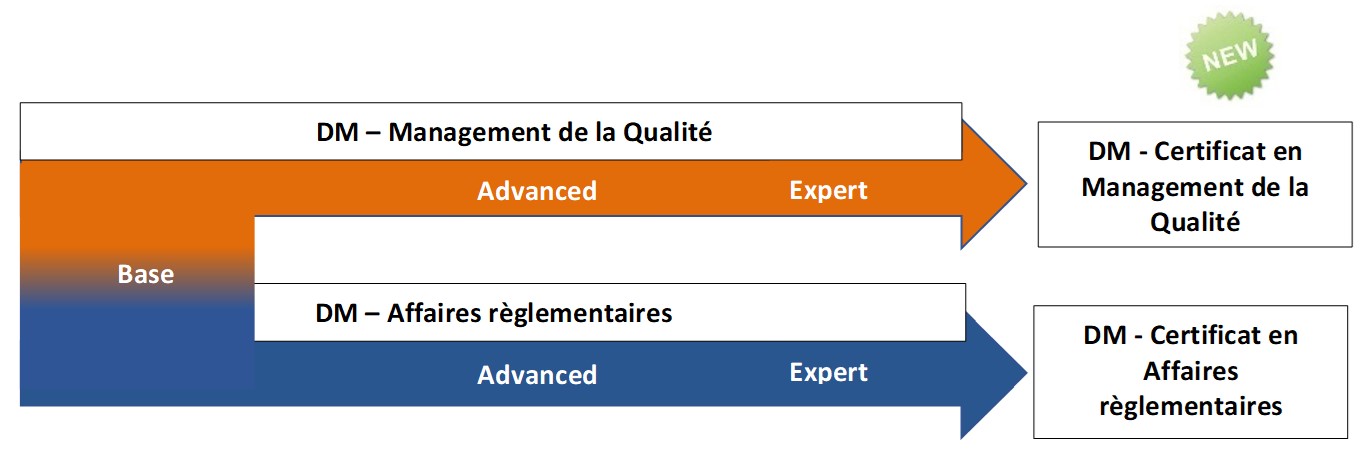
Base en Management Qualité et Affaires règlementaires pour dispositifs médicaux